Menu


Históricamente, la anestesiología es la especialidad médica que más esfuerzos ha realizado para mejorar la seguridad del paciente. Basta recordar que en 1985 –y no es, ni mucho menos, la primera iniciativa en la especialidad–, se creó en Estados Unidos la Anesthesia Patient Safety Foundation, cuya misión es asegurar que ningún paciente sea dañado por la anestesia. Pero la seguridad del paciente ha trascendido el ámbito de nuestra especialidad y ha llegado a convertirse en el tema de moda en todo el mundo sanitario. De hecho, más de diez años después de que el Institute of Medicine publicara el polémico informe To err is human(3.1), que conmocionó al mundo al afirmar que los errores médicos evitables provocaban más muertes que los accidentes de tráfico, el cáncer de mama y el SIDA juntos, la seguridad del paciente es un tema que sigue estando en la agenda(3.2). Las cifras estimadas de mortalidad debida a la asistencia sanitaria en Estados Unidos y publicadas en aquel informe procedían de varios trabajos que habían revisado las historias clínicas de pacientes ingresados utilizando un cuestionario de cribado para la detección de efectos adversos.
Brennan et al revisaron 30.195 historias clínicas y encontraron que 3,7 % de los pacientes ingresados en 51 hospitales del estado de Nueva York en 1984 sufrían un evento adverso, que era mortal en 13,6 % de los casos(3.3, 3.4). Gawande et al, por su parte, estudiaron 14.700 historias clínicas y descubrieron que 2,9 % de los pacientes ingresados en 28 hospitales de Utah y Colorado durante el año 1992 sufrieron un evento adverso y 6,6 % de ellos fallecieron como consecuencia del mismo(3.5, 3.6). La extrapolación de las cifras de mortalidad de dichos estudios a un ámbito nacional, dio como resultado que entre 44.000 y 98.000 pacientes fallecían cada año en Estados Unidos por errores médicos evitables, siendo la séptima causa de muerte en el país.
En la primera década del siglo XXI se han multiplicado los estudios realizados en el ámbito hospitalario del mundo desarrollado para conocer la magnitud del problema (tabla 3.1). En Gran Bretaña, un informe de un grupo de expertos en el aprendizaje sobre efectos adversos en el National Health System(3.7) afirmaba que se producían 850.000 efectos adversos al año en los hospitales públicos del país, con un coste directo de dos billones de libras solo en días adicionales de estancia. Vincent et al realizaron una revisión retrospectiva de más de mil historias clínicas en dos hospitales londinenses durante los años 1999 y 2000, y hallaron que el 10,8 % de los pacientes experimentaban un evento adverso –48 % evitables–, lo que supuso una prolongación de la estancia hospitalaria de 8,5 días por cada evento adverso y un coste anual total estimado para el sistema nacional de salud de un billón de libras(8).
| Tabla 3.1. Estudios nacionales y multinacionales sobre eventos adversos ligados a la asistencia sanitaria | ||||
|---|---|---|---|---|
| Ref | Estudio | Ámbito (fecha de ingreso) | Nº ingresos o consultas | % eventos adversos |
| (3, 4) | Estados Unidos (Harvard Medical Practice Study) | Hospitales agudos (1984) | 30195 | 3.8 |
| (5, 6) | Estados Unidos (Utah y Colorado) | Hospitales agudos (1992) | 14565 | 3.2 |
| (5, 6) | Estados Unidos (Utah y Colorado)a | Hospitales agudos (1992) | 14565 | 5.4 |
| (9) | Australia (Quality in Australian Health Care Study) | Hospitales agudos (1992) | 14179 | 16.8 |
| (9) | Australia (Quality in Australian Health Care Study)b | Hospitales agudos (1992) | 14179 | 10.6 |
| (8) | Reino Unido | Hospitales agudos (1999-2000) | 1014 | 11.7 |
| (10) | Dinamarca | Hospitales agudos (1998) | 1097 | 9.0 |
| (11, 12) | Nueva Zelanda | Hospitales agudos (1998) | 6579 | 11.3 |
| (13) | Canadá | Hospitales agudos (2000) | 3745 | 7.5 |
| (14) | Francia (ENEIS) | Hospitales agudos (2004) | 8754 | 21.1 |
| (15) | Francia (ENEIS) | Hospitales agudos (2004) | 8754 | 6.6/1000 días |
| (16) | Holanda | Hospitales agudos (2004) | 7926 | 5.7 |
| (17) | Suecia | Hospitales agudos (2003-2004) | 1967 | 12.3 |
| (18) | España (ENEAS) | Hospitales agudos (2005) | 5624 | 9.3 |
| (19) | España (APEAS) | Atención primaria (2007) | 96047 | 1.15 |
| (20) | Iberoamérica (IBEAS) | Hospitales agudos (2007-2008) | 11379 | 10.5 |
a Datos armonizados con la metodología del estudio australiano.
b Datos armonizados con la metodología del estudio de Utah y Colorado.
En Australia, una revisión de 14.700 historias clínicas en 28 centros hospitalarios encontró que un 16,6 % de los ingresos se asociaron a un evento adverso, que se consideró evitable en el 51 % y resultó mortal en el 4,9 %(3.9). En Nueva Zelanda, una revisión retrospectiva de 6.579 historias clínicas en 13 hospitales públicos durante 1998 encontró una incidencia de efectos adversos del 11,3 % y en un 1,8 % de los casos se asoció la muerte del paciente(3.12). En esta serie se consideró que el 61,6 % de los efectos adversos fueron evitables(3.11, 3.22).
En Canadá, un estudio multicéntrico en el que participaron 20 hospitales durante el año 2000 y en el que se revisaron 3.745 historias clínicas, encontró una incidencia del 7,5 %(3.13) de efectos adversos, de los cuales un 36.9 % se consideraron evitables y un 20.8 % fallecieron como consecuencia de los mismos, permitiendo realizar una estimación anual nacional de 185.000 efectos adversos, cerca de 70.000 potencialmente evitables y alrededor de 39.000 muertes. Otro estudio realizado en el mismo país en un hospital de Ottawa(3.23) revisó 502 historias clínicas y encontró una incidencia del 12,7 % de efectos adversos, un 37,5 % de los cuales se consideraron evitables y un 4,68 % produjeron la muerte.
En Dinamarca, Schioler et al(3.10) realizaron un estudio retrospectivo en el que revisaron 1.097 ingresos durante el año 1998 en 17 hospitales y encontraron una prevalencia de efectos adversos en el 9 % de los ingresos. El 40.4 % de los efectos adversos se consideraron evitables.
En Francia, la Enquete Nationale sur Événements Indésirables graves liés aux soins (ENEIS), en la que participaron 71 hospitales durante el año 2004 y se revisaron 8.754 pacientes, concluyó que la incidencia de efectos adversos graves era del 5.1 % (efectos adversos totales 21.1 %), 46.2 % fueron considerados evitables y terminaron con la vida de los pacientes en 4.6 %(3.14). Sin embargo, dos años después, una publicación internacional del mismo grupo estudiando la misma serie, arrojó unos resultados algo diferentes al tener en cuenta solo un 26 % de los pacientes de la muestra, aquéllos en los que los efectos adversos graves aparecían durante la hospitalización y eran dados de alta antes de finalizar el período de observación. Quedaban excluidos aquellos pacientes cuyo motivo de ingreso fue un evento adverso y los que al finalizar el período de observación continuaban ingresados (3.15). Con esas consideraciones, la incidencia por mil días de hospitalización fue del 6,6 %, el 8,2 % de los efectos adversos se asociaron a la muerte del paciente y el 37,2 % se consideraron evitables.
En Holanda, Zegers et al(3.16) realizaron una revisión retrospectiva de 7.926 pacientes ingresados en 21 hospitales durante el año 2004 y encontraron una incidencia de efectos adversos del 5.7 %, de los que juzgaron como evitables el 39.6 %. Más del 54 % ocurrieron en procedimientos quirúrgicos. Los efectos adversos contribuyeron a la muerte del paciente en un 7.6 %.
En Suecia, Soop et al(3.17) revisaron 1.967 ingresos en 28 hospitales durante los años 2003 y 2004 para llegar a la conclusión de que el 12.3 % de los ingresos sufría un evento adverso, que en un 70 % de los casos se consideró evitable. El 62 % de los efectos adversos ocurrió en especialidades quirúrgicas. Un 3 % del total se asoció a la muerte del paciente.
En nuestro país, el Estudio Nacional sobre los Efectos Adversos ligados a la hospitalización (ENEAS)(3.18) realizado en 24 hospitales públicos, revisó la historia clínica de 5.624 pacientes y encontró una incidencia de efectos adversos del 9.3 %, de los cuales el 42.6 % se consideró evitable y un 4.4 % se asoció a la muerte del paciente. Las cifras anuales estimadas para todo el estado ascenderían entonces a 418.000 efectos adversos, 178.000 efectos adversos evitables y 18.400 muertes. En 2008 el Ministerio de Sanidad y Consumo publicó el estudio APEAS(3.19), estudio sobre la seguridad de los pacientes en atención primaria de salud, en el que se revisaron 96.047 consultas y se encontró una prevalencia de efectos adversos de 18.63 por mil, la mayor parte leves o moderados (92.7 %) y evitables (70.2 %).
En 2009 el Ministerio de Sanidad y Política Social publicó el estudio IBEAS sobre prevalencia de efectos adversos en hospitales de Latinoamérica, en el que participaron cinco países y se estudiaron 11.426 pacientes. La prevalencia de efectos adversos fue del 10.5 % y un 6.7 % produjo la muerte del paciente(3.20).
Siempre en nuestro país, en lo relativo a costes de la no seguridad relacionados con la medicación, un estudio realizado en el año 2011 sobre la infección nosocomial y los procedimientos quirúrgicos en pacientes hospitalizados, reveló un gasto de 2.474 millones de euros para el SNS español (3.21).
Todas las cifras aportadas por los estudios mencionados han estado sujetas a polémica y consideradas en ocasiones difícilmente comparables. Se han señalado al menos cinco diferencias metodológicas entre los estudios de Utah y Colorado(3.6) y el estudio australiano(3.9), que se refieren tanto a los criterios de selección de historias clínicas en la primera etapa de revisión por enfermeras, al umbral para atribuir un efecto a una causa médica, al número de médicos que componían el equipo de la segunda etapa de revisión, al método de cálculo y la inclusión de los efectos adversos(24), además de unos objetivos distintos en cada estudio(25). Todo ello hace que unas incidencias de efectos adversos aparentemente muy discrepantes entre ambos trabajos no fuesen al final tan amplias. Por otro lado, el diseño metodológico de estos estudios no permite, aunque se ha hecho, establecer una asociación entre el evento adverso y la muerte de los pacientes, ni siquiera asignar definitivamente a un evento adverso un carácter evitable. Fundamentalmente han servido para que, en primer lugar, todos los países interesados tuviesen un estudio nacional que determinase su posición en el mundo y, más importante aún, han puesto de manifiesto un problema hasta entonces poco debatido a esta escala, estimulando el desarrollo de actividades dirigidas a mejorar la seguridad de los pacientes.
Una de las limitaciones señaladas para la comparación entre las cifras de los distintos estudios mencionados, ha sido la utilización de definiciones distintas, es decir, la ausencia de una taxonomía común en seguridad del paciente. La Organización Mundial de la Salud (OMS) puso en marcha en el año 2004 la Alianza Mundial por la Seguridad del Paciente (AMSP) con el objetivo de coordinar, difundir y acelerar la mejora de la seguridad del paciente en todo el mundo y como medio para propiciar la colaboración internacional y la adopción de medidas entre los estados miembros, la secretaría de la OMS, los expertos técnicos y los consumidores, los profesionales y los grupos industriales(3.26). La AMSP diseñó inicialmente seis áreas de acción, una de las cuales estaba específicamente dedicada a elaborar una taxonomía internacional en seguridad del paciente.
En un informe publicado en enero de 2009, este grupo recogía hasta nueve definiciones distintas de la expresión “seguridad del paciente” que habían sido utilizadas en la bibliografía publicada hasta la fecha(3.27). En ese documento de la AMSP se establecía que la seguridad del paciente es la reducción, hasta un mínimo aceptable, del riesgo de sufrir un daño innecesario asociado a la asistencia sanitaria (otras definiciones relevantes sobre el tema establecidas por la AMSP aparecen en la tabla 3.2).
El sistema nacional de salud británico en su informe “Seven steps to patient safety”(3.28), definió la seguridad del paciente como el proceso por el que una organización hace más seguro el cuidado del paciente. Este proceso debería incluir una evaluación del riesgo, la identificación y gestión de los riesgos relacionados con el paciente, la notificación y el análisis de incidentes y la capacidad de aprender de los incidentes y de implantar soluciones para minimizar el riesgo de que reaparezcan.
| Tabla 3.2. Algunas definiciones establecidas por la AMSP |
|---|
Seguridad del paciente
Ausencia para el paciente de un daño innecesario, real o potencial, asociado a la asistencia sanitaria.
Daño asociado a la asistencia sanitaria
Daño que surge o se asocia a planes o acciones tomados como parte de la asistencia sanitaria más que debida a la patología del paciente
Incidente
Evento o circunstancia que pudo haber producido, o terminó produciendo, un daño innecesario a un paciente.
Evento adverso
Incidente que produjo un daño a un paciente.
Casi incidente (near miss o close call en la terminología inglesa)
Incidente que no causó un daño a un paciente.
Factor contribuyente (factor latente en la terminología de Vincent)
Circunstancia, acción o influencia que se piensa que ha jugado un papel en el origen o desarrollo de un incidente, o que aumenta el riesgo de que se produzca.
No tiene acceso al contenido completo de este capítulo.
Puede comprar únicamente este capítulo por 15,00€.

No tiene acceso al contenido completo de este capítulo.
Puede comprar únicamente este capítulo por 15,00€.

La unión neuromuscular es la sinapsis más estudiada del sistema nervioso, modelo de investigación y pionera en el descubrimiento de la trasmisión sináptica. Durante años se estudió de una manera exhaustiva, topándose con su complejidad, tarea que animó a los investigadores. Se prestó al principio más importancia al terminal postsináptico y sin embargo en los últimos años el interés por una “desconocida” terminal presináptica ha permitido empezar a desentrañar la estructura molecular y funcional de la vesícula sináptica y su proceso de exocitosis. El desarrollo de la biología molecular y la tecnología de la imagen lo están haciendo posible. Su comprensión permitirá una mejor utilización de los relajantes musculares, así como de su monitorización.
El músculo esquelético está inervado por nervios motores de axones con mielina, tipo Aα, provenientes de la segunda motoneurona, situada a nivel anterior de la médula espinal. Entran en el músculo generalmente por su centro, y se dividen en varias ramas, que después de perder su vaina de mielina (a la altura del último nódulo de Ranvier), dejando paso a las células de Schwann, van a unirse con las fibras musculares y formar la placa motora. Es importante reseñar que dichas células de Schwann juegan un papel relevante en el establecimiento de la conexión entre el nervio y el músculo, protegen el terminal presináptico y contribuyen a su regeneración en caso de daño(12.1, 12.2, 12.3, 12.4). Cada nervio inerva un importante número de fibras musculares, unas 500, constituyendo grupos funcionales, las unidades motoras. Esta inervación puede ser: focal, o en placas, en la que cada fibra muscular es inervada por una sola sinapsis, siendo esta la forma más común en el hombre, o bien múltiple, en la que las fibras reciben una inervación densa a lo largo de sus membranas provenientes de varias terminales nerviosas, por su forma dan la impresión de racimos de uva (12.5, 12.6, 12.7, 12.8). Este tipo de inervación, poco habitual, es el que se encuentra en los músculos extraoculares, intrínsecos de la laringe y faciales. Otra peculiaridad es que los axones suelen corresponder al tipo Aᵞ .
En el feto las fibras musculares tienen inervación múltiple, perdiéndose esta configuración en el periodo postnatal, pasando a una terminal nerviosa por cada fibra muscular (12.9).
En la placa motora, el 80% del material necesario para la formación de las vesículas sinápticas proviene del cuerpo neuronal, transportado a la terminal presináptica a través de microtúbulos. Existe además una disposición en la que los ribosomas y las mitocondrias están alejadas del espacio sináptico. Las vesículas sinápticas, encargadas del transporte de la acetilcolina (ACh), se encuentran en el interior de la terminal unidas al citoesqueleto, fracción de reserva (VP1), y en unas zonas próximas a la membrana presináptica llamadas zonas activas (cresta alargada que contiene vesículas como cuentas de collar), (500-1000 por axón), y la fracción de liberación rápida (VP2) (12.10) (450 Å de diámetro, 50 Å de espesor, 50 por zona activa).
La membrana presináptica contiene básicamente un receptor α3β2 (12.11) regulador de la entrada de calcio, responsable del decaimiento producido por los bloqueantes neuromusculares no despolarizantes (BNM ND) y dos purinoreceptores A1 presinápticos, activados por la hidrólisis del ATP en adenosina, regularía la entrada de calcio y el A2a activado por el ATP pero no por la adenosina (12.12, 12.13). Existen también varios canales: de calcio (12.14, 12.15) voltaje-dependiente, canal P, canales de potasio voltaje-dependiente y también calcio-dependientes, que regularían la entrada de calcio a través de los canales P.
El espacio sináptico o hendidura sináptica (20-50 nm) está situado entre la membrana presináptica y la membrana postsináptica, en él se encuentra la membrana basal o teloglía de Couteaux, que une las dos membranas opuestas mediante puentes de colágeno y unida a esta también mediante puentes la acetilcolinesterasa (AChasa), con una densidad de 2000/µm2. Este espacio no está compuesto por plasma por lo que las moléculas de relajantes se mueven a través del intersticio. Sin embargo, su concentración, por la ley de acción de masas, mantiene un equilibrio con el plasma mediante una constante de equilibrio Ke0.
En el terminal postsináptico la membrana se halla plegada, formando una serie de invaginaciones y crestas. En las crestas se enfrentan las zonas activas presinápticas donde se encuentran situados, casi exclusivamente, los receptores nicotínicos de acetilcolina (nAChR). Su densidad en estos lugares es muy alta (10.000/µm2), dando un aspecto pavimentado. Los receptores aparecen como anillos o rosetas de 8-9 nm, con un orificio central, y agrupados en pares, alineándose en hileras bien definidas, anclados a la membrana mediante una proteína, la rapsina (12.16, 12.17, 12.18).
En íntima relación con los receptores nicotínicos de acetilcolina, en los valles de las invaginaciones se encuentran los canales de sodio (12.19, 12.20) que transmiten la despolarización hacia ambos lados de la membrana muscular. Esta despolarización avanza hacia el interior de la fibra muscular a través de los túbulos T (TT) en estrecho contacto con los sacos laterales del retículo sarcoplásmico (RS), esta unión del túbulo T entre dos sacos laterales se denomina triada. La conexión entre la membrana del TT y la membrana de RS es a través de una proteína llamada pedículo. En esta zona del retículo sarcoplásmico se encuentran las reservas de calcio de la fibra muscular, que permiten contraerse a la fibra sin necesidad de depender del calcio del exterior.
En el pedículo se encuentran dos receptores que abren dos canales de calcio; receptor de dihidropiridina (DHP) dependiente de voltaje y el receptor de rianodina (RR) activado por la liberación de calcio que proviene del DHP y encargado de gestionar la entrada del calcio a la zona contráctil (12.21). La importancia de receptor RR es tal que su daño produciría la hipertermia maligna, donde el calcio entra sin control en el sarcómero.
En la zona contráctil, donde se produce el fenómeno de acoplamiento excitación-contracción, nos encontramos con una membrana con dos formaciones discoideas o disco Z, entre dos discos Z se encuentra el sarcómero, unidad básica de la contracción. Anclada a esta estructura se encuentra la actina (12.22), miofilamento de color claro, de forma esférica (actina G) aunque en la unidad contráctil es de dos cadenas helicoidales entrelazadas (actina F), presentando en todo el rosario de cabezas G unas zonas de unión a la miosina donde se produce la hidrólisis de ATP. La actina está asociada a dos proteínas fundamentales para su dinámica de funcionamiento, la tropomiosina con disposición helicoidal doble, esta es la forma lógica para seguir a la doble hélice de la actina y cubrir sus cabezas activas impidiendo su unión a la miosina, mientras el calcio no ponga en marcha el mecanismo contráctil, y en segundo lugar, la troponina, en forma de cabeza con tres subunidades: troponina I, inhibe la unión de actina y miosina, troponina T, subunidad de unión a la tropomiosina y troponina C, subunidad de unión al calcio.
El otro miofilamento, la miosina, de color oscuro, cabeza globular y larga cola en doble hélice, tiene en su cabeza dos zonas catalíticas con actividad ATPasa activadas por calcio. Por tanto, entre dos discos T, está el sarcómero, unidad básica contráctil, con dos bandas claras (actina) y una banda oscura (miosina) (12.23).
La ACh se sintetiza en la terminal axónica a partir de la colina (que proviene en un 50% de la destrucción enzimática de la ACh liberada). La colina entra en la célula por un sistema de transporte activo energía-dependiente, allí toma un grupo acetilo de la acetilcoenzima A bajo la influencia catalítica de la colino-acetiltransferasa.
La acetilcoenzima A se produce en las mitocondrias axonales. La colino-acetiltransferasa se produce en los ribosomas del cuerpo celular.
Una vez sintetizada, la ACh se almacena en pequeñas vesículas claras, mediante un sistema específico de transporte de alta energía, una bomba de protones que requiere ATP (12.24, 12.25). Una vez la ACh en el interior de las vesículas, estas se sitúan fundamentalmente en dos lugares, el 80% en la parte central del terminal presináptico, fracción de reserva (VP1), anclada en el citoesqueleto formado por filamentos de actina que a su vez se unen a la sinapsina 1, sinaptotagmina y la espectrina. El 20% restante se distribuye en las zonas activas formando la fracción de liberación inmediata (VP2), que a su vez están enfrentadas a las crestas donde se encuentran los nAChRs, lo que le llevaría a recorrer un espacio mínimo tras su liberación, manteniendo con esto el principio de rapidez y eficiencia energética (12.26).
Las vesículas son unas organelas esféricas de unos 20 nm-40 nm, cuya membrana fosfolipídica está ocupada por una bomba de protones, que ocupa aproximadamente el 10% de su superficie, y un grupo de proteínas de membrana encargadas de modular, sensar y ejecutar los procesos de movilización, acople o atraque, fusión y exocitosis.
Destacaremos solo aquellas que tengan un papel importante y cuya función esté suficientemente aclarada por las investigaciones.
La sinapsina es la encargada de la unión de la vesícula al citoesqueleto mediante su interacción con la actina. La sinaptofisina, que buscaría al complejo SNARE, la sinaptotagmina 1 y 2 que buscarían las zonas de alta actividad del calcio uniéndose al complejo SNARE y jugando un papel importante en la fusión, la sinaptobrevina/VAMP (vesícula asociada a la proteína de membrana) proteína del complejo SNARE (proteína soluble de anclaje a receptores sensibles a N-etilmaleimida) que busca el acople con las otras dos proteínas del complejo, SNAP25, sintaxina1, ambas en la membrana presináptica, y la Rab3 íntimamente ligada a la fusión.
La liberación de ACh se produce fundamentalmente a nivel de las zonas activas de la membrana presináptica, lugares bien delimitados por microscopía electrónica, electrodensos, donde se condensan la gran mayoría de las vesículas sinápticas que van a ser liberadas de una manera rápida, fracción de liberación inmediata (VP2). Sin embargo, esta zona depende íntimamente de las vesículas de almacenamiento en la llamada fracción de reserva (VP1), ya que la estimulación repetida del nervio induce una gran liberación de ACh de la fracción VP2, que es repuesta por el VP1 mediante un acción de movilización, incluyendo también la formación de ACh, siendo este el punto que ralentiza la movilización. Una vez iniciado este paso, es seguido por otros tres que desembocan en la liberación de ACh al espacio sináptico, acople o atraque, fusión y exocitosis.
La movilización se produce cuando un estímulo más intenso hace que penetre más profundamente el calcio en el citoplasma, o se transporte a través de los canales de calcio L, uniéndose a la calmodulina que, a su vez, activa a la enzima proteincinasa II que fosforila a la sinapsina permitiendo que la vesícula rompa su unión al citoesqueleto. Una vez liberada, la vesícula es guiada por proteínas de su membrana hacia la zona activa. En esta zona se encuentran unas proteínas, canales del calcio, del tipo P, los cuales se abren tras la llegada de un potencial de acción. La entrada de calcio al interior del terminal presináptico, supone la puesta en marcha de los mecanismos que terminaran en la exocitosis. El eje central de los tres movimientos restantes es el complejo SNARE (12.27) formado por tres proteínas, la sinaptobrevina1/VAMP1 en la membrana de la vesícula sináptica, el SNAP-25 y la sintaxina 1 que se encuentran en la membrana presináptica. Con la entrada del calcio al interior del terminal presináptico se inicia el proceso de unión de la sinaptobrevina 1/VAMP1 con las otras dos proteínas del complejo, y de la SM (Sec1/Munc18-1) con la sintaxina 1, una proteína que ha evidenciado en los últimos años, y en investigaciones recientes se ha demostrado, vital en el proceso de fusión y posterior exocitosis (12.28, 12.29). En la regulación de este proceso intervienen otras dos proteínas, la sinaptotagmina (1 y 2) es también responsable de la alineación de las vesículas sinápticas en las zonas activas que contienen dos dominios de unión al calcio que regularían dos tipos de exocitosis: una sincrónica, cuando la entrada de calcio es adecuada y otra asincrónica probablemente cuando los niveles de calcio son bajos. Participa en la fusión uniéndose a los fosfolípidos de la membrana para la formación del poro y posterior exocitosis. Una segunda proteína, la Rab3, interactuaría con otras proteínas en su forma RIM 1α (Rab3-interación molecular) contribuyendo también a la fusión y posterior exocitosis. Por tanto, la entrada de calcio permite el acople y fusión del complejo SNARE/SM Munc18-1 (12.30) y la sinaptotagmina1 y 2 (12.31) unida al calcio, esto traerá como consecuencia la apertura de un poro mediado por otra proteína, la Rab3 (RIM1α) y la exocitosis.
Para Südhof (12.30), estos hallazgos sugieren una organización económica inesperada de la maquinaria secretora, en ella los diferentes pasos son mediados por las mismas moléculas a través de diferentes mecanismos.
El contenido de una vesícula se denomina cuanto (unas 6.000-10.000 moléculas de ACh). En reposo se liberan pequeñas cantidades de cuantos de forma regular, los micropotenciales de placa terminal, que no se propagan. Solo la llegada del potencial de acción nervioso y la entrada de Ca2+ liberan una cantidad suficiente de cuantos (50-200) capaz de producir suficientes micro potenciales de placa Terminal (MPPT) que darán lugar a un potencial de placa terminal que se propagará a las zonas próximas activando los canales de sodio con la consiguiente despolarización de la membrana muscular (12.32, 12.33, 12.34).
Una vez conseguida la exocitosis las vesículas son recicladas y recargadas de nuevo de tres maneras, dos vías rápidas utilizadas a frecuencias de estimulación bajas y una vía lenta a frecuencias de estimulación más altas, donde la vía rápida no tiene capacidad. Las dos vías rápidas ocurren, una en la zona activa "kiss and stay", otra en las proximidades sin ser una endocitosis mediada por clatrina "kiss and run" y la vía lenta, lejos de la zona activa y es una endocitosis mediada por clatrina (12.35).
Cuando la ACh es inyectada en la hendidura sináptica, el 50% se hidroliza por una enzima de las más rápidas de la naturaleza, la AChasa, caracterizada por ser catalítica, carboxilesterasa tipo B, forma proteica A12 o asimétrica. Se encuentra anclada mediante puentes de colágeno a la membrana basal, aunque se sintetiza en la placa motora del músculo (12.36). En su camino hacia los receptores, la ACh tiene que atravesar la zona de la AChasa, lugar que se ajusta al principio del recorrido mínimo, gasto mínimo y efectividad máxima, al encontrarse concentrada en el área por donde obligatoriamente pasará el ligando. La ACh que no es hidrolizada en el primer paso, lo será tras desprenderse del receptor. La hidrólisis se produce en un canal que llega al centro de la proteína, y que en su entrada es regulado por moléculas que de una manera dinámica facilitan el paso de ACh (12.37, 12.38). Existe también lo que sería una “puerta trasera” regulada por una tirosina, que gira para crear un canal por donde se eliminarían los productos resultantes de esa catálisis de sitio activo (12.39).
Su rendimiento se incrementa o disminuye según la actividad muscular. Siendo la denervación una de las principales causas de su disminución tanto en la zona sináptica como extrasináptica. Enfermedades congénitas y adquiridas (intoxicación de pesticidas organofosforados o gases nerviosos, así como el tratamiento crónico con piridostigmina administrado como profilaxis de intoxicación por gases nerotóxicos) disminuyen su actividad produciendo lo que parece un síndrome miasténico, que va más allá de la simple sintomatología, ya que produciría una disminución de la actividad, una pérdida en el mantenimiento del sistema neuronal motor y en la organización en las ramas terminales del nervio (12.40).
La ACh liberada en el espacio sináptico y que consigue esquivar la acción de la AChasa, activa los receptores colinérgicos de tipo nicotínico de la membrana muscular postsináptica, existiendo del orden de medio millón de éstos disponibles en cada unión.
Tras unirse la ACh al receptor, éste se abre en menos de 10 µs, permaneciendo abierto durante 1 ms. En este tiempo pasan 104 cationes, actuando así el conjunto como un poderoso amplificador (12.41). Se produce la apertura de un canal iónico permitiendo la entrada de Na+ y la salida de K+, dando lugar al micropotencial de placa terminal (MPPT), que unido a otros micropotenciales dan lugar al potencial de placa terminal (PPT). Este potencial inicia la despolarización activando los canales de sodio que permiten la transmisión de la señales a través de la membrana muscular (sarcoplásmica) (Fig 12.1).
No tiene acceso al contenido completo de este capítulo.
Puede comprar únicamente este capítulo por 20,00€.

La realización rutinaria de un considerable número de pruebas preoperatorias para evaluar el estado de salud del paciente es una práctica generalizada en los sistemas sanitarios, con independencia de la necesidad individual del paciente y del grado de evidencia científica sobre la efectividad y seguridad de cada prueba. Se define solicitud rutinaria de pruebas complementarias preoperatorias como el conjunto de pruebas diagnósticos solicitadas en pacientes aparentemente sanos y asintomáticos, en ausencia de indicación clínica o sospecha de morbilidad y con el objetivo de reconocer problemas o alteraciones que no se hayan identificado previamente con la historia clínica y la exploración física (17.1, 17.2). Desde el año 1989 en el que se publicó en Suecia el primer informe de evaluación de la Red Internacional de Agencias de Evaluación de Tecnologías Sanitarias (INAHTA) sobre “Rutinas Preoperatorias” hasta la actualidad, se han publicado varios documentos relativos a este tema por otros tantos grupos científicos (17.3-17.15). En todos ellos se ha puesto de manifiesto que no existen beneficios en la solicitud rutinaria de pruebas complementarias preoperatorias, y por eso, su uso debería estar limitado a aquellos pacientes en los que la historia clínica y la exploración física así lo indiquen, o ante la presencia de determinados factores de riesgo (edad avanzada, tipo de intervención, etc.). La aplicación de esta lógica consigue mejorar tanto la atención sanitaria del paciente, como el uso apropiado de los recursos sanitarios en la fase de evaluación preoperatoria. Aproximar la solicitud de las pruebas preoperatorias a estas recomendaciones propuestas en la literatura científica podría tener un gran impacto, tanto desde el punto de vista clínico, como económico y social (17.16).
El 25% de los pacientes anestesiados tienen antecedentes de patología cardiovascular que incrementan la morbilidad y la mortalidad preoperatorias. Por ello, es imprescindible una minuciosa valoración cardiovascular en el paciente que precisa una intervención quirúrgica (17.2). Un cierto número de patologías cardíacas potencialmente capaces de alterar el tratamiento anestésico del paciente sólo pueden ser descubiertas por el ECG (17.17) (isquemia silente, infarto de miocardio asintomático, bloqueo AV en sus distintos grados, intervalo PR corto, etc.). Las recomendaciones actuales para la solicitud del ECG preoperatorio en pacientes sanos asintomáticos están basadas en dos factores que aumentan el riesgo cardiovascular del paciente, la edad y el sexo masculino. El aumento de la edad se asocia con un mayor número de aparición de anomalías electrocardiográficas. Los límites de edad más empleados oscilan entre los 60 años en mujeres y los 40 años en varones. El porcentaje de anomalías encontradas en los ECG preoperatorios solicitados rutinariamente es alto (entre el 3,7 y el 52,2% según el estudio consultado). Sin embargo, el porcentaje de anomalías que presentan riesgo para el paciente suele ser inferior al 30%, no esperadas por la historia clínica del enfermo inferior al 10% y que originen un cambio en el tratamiento clínico habitual entre el 0,5-2% de los pacientes. Por ello, el ECG preoperatorio debería solicitarse únicamente en pacientes con factores conocidos que incrementan el riesgo de padecer enfermedad cardiaca, como la edad, hipertensión, hipercolesterolemia, consumo de tabaco, diabetes, obesidad severa (IMC>40 kgm-2), antecedentes familiares de cardiopatía isquémica, enfermedad pulmonar o consumo ilícito de drogas (tabla 1) (17.1, 17.17, 17.18).
| Tabla 17.1. Recomendaciones de la Solicitud del ECG Preoperatorio en Cirugía Electiva extraídas de las Revisiones Sistemáticas de la Literatura | ||
|---|---|---|
| Pacientes Asintomáticos | Pacientes Sintomáticos | |
| SBU 1989 (3) | Hombres > 50-60 años Mujeres > 60-70 años | Cardiópatas |
| ANDEM 1992 (4) | Hombres > 40-45 años Mujeres > 55 años | Antecedentes o signos de patología cardiaca (incluido arritmias) Enfermedad sistémica asociada a problemas cardiacos (HTA, EVP, enf. Infecciosa, neoplasias, colagenosis) Tratamiento con fármacos cardiotóxicos (fenotiacinas, ADT, doxirrubicina) Alteraciones electrolíticas importantes |
| OSTEBA 1994 (5) | Hombres y mujeres > 60 años Pacientes > 40 años sin ECG previo | |
| GR 1997 (7) | Hombres y mujeres > 60 años | Patología cardiaca, HTA, patología pulmonar Tratamiento con digital en > 45 años Radioterapia DMID |
| NCCHTA 1999 (8) | No está indicado | |
| GPAC 2000 (9) | No está indicado | Hombres y mujeres > 40 años con DMID |
| AEC 2001 (14) | Hombres y mujeres > 60 años Hombres y mujeres > 40 años sin ECG previo Fumadores > 1 paquete cigarrillos/día Obesos con IMC > 30 | Patología cardiaca Enfermedad sistémica posiblemente asociada a cardiopatía Tratamiento con fármacos potencialmente cardiotóxicos |
| NICE 2003 (11) | Hombres y mujeres > 80 años | |
| ICSI 2008 (12) | Hombres y mujeres > 55 años sin ECG previo en un año | Con independencia de la edad, en: diabetes, EVP, HTA, dolor torácico, ICC, fumador, incapacidad al ejercicio y obesidad mórbida |
SBU= The Swedish Council on Technology Assessment in Health Care; ANDEM= Agence Nationale pour le Developement de l’Evaluation Medicale; OSTEBA= Evaluación de Tecnología Sanitaria del Gobierno Vasco; GR= Health Council of the Netherlands; NCCHTA= National Coordinating Centre for Health Technology Assessment; GPAC= Guidelines & Protocols Advisory Committee; AEC= Asociación Española de Cirujanos; NICE= National Institute for Clinical Excellence; ICSI= Institute for Clinical Systems Improvement. ECG= electrocardiograma; HTA= hipertensión arterial; EVP= enfermedad vascular periférica; ADT= antidepresivos tricíclicos; DMID= diabetes mellitas insulin-dependiente; IMC= índice de masa corporal; ICC= insuficiencia cardiaca congestiva.
Se estima que el 50% de todos los procedimientos radiológicos hospitalarios son radiografías de tórax, muchas de ellas solicitadas de manera rutinaria antes de procedimientos quirúrgicos (17.19). El objetivo fundamental de la realización de RTPO es:
a) detectar anomalías esqueléticas, respiratorias o cardiacas que incrementen el riesgo de muerte y/o de complicaciones graves durante o después de la cirugía o constatar las ya conocidas b) detectar anormalidades asintomáticas, con el fin de poder realizar cambios en la actitud para poder disminuir el riesgo operatorio c) establecer una valoración basal con la que poder comparar en el postoperatorio si aparecieran complicaciones d) proporcionar una cobertura médico-legal (17.16, 17.19)
| Tabla 17.2. Recomendaciones de la Solicitud de la Radiografía de Tórax Preoperatoria en Cirugía Electiva Extraída de las Revisiones Sistemáticas de la Literatura | ||
|---|---|---|
| Pacientes Asintomáticos | Pacientes Sintomáticos | |
| SBU 1989 (3) | Inmigrantes de países en vías de desarrollo sin Rx tórax en los 12 meses anteriores | Síntomas de patología respiratoria aguda Patología cardiopulmonar Riesgo de presentar metástasis |
| ANDEM 1992 (4) | Inmigrantes de países en vías de desarrollo sin Rx tórax en los 12 meses anteriores | Síntomas de patología respiratoria aguda Patología cardiopulmonar Riesgo de presentar metástasis |
| OSTEBA 1994 (5) | Hombres y mujeres > 60 años Obesos con IMC > 30 Fumadores de > 20 cigarrillos/día | |
| GR 1997 (7) | Inmigrantes de países en vías de desarrollo sin Rx tórax en los 12 meses anteriores Fumadores de larga duración | Patología respiratoria Patología cardiovascular Neoplasias evolucionadas Cirugía cardiaca y torácica alta |
| NCCHTA 1999 (8) | No está indicada | |
| GPAC 2000 (9) | No está indicada | |
| AEC 2001 (14) | Hombres y mujeres > 60 años Obesos con IMC > 30 Fumadores > 1 paquete cigarrillos/día Bocio moderado o grande | Patología respiratoria o cardiovascular Neoplasias evolucionadas Enfermedad sistémica con posible afectación torácica |
| NICE 2003 (11) | No está indicada | Pacientes con signos y/o síntomas sugestivos de patología cardiopulmonar nueva o inestable |
| ICSI 2008 (12) | ||
SBU= The Swedish Council on Technology Assessment in Health Care; ANDEM= Agence Nationale pour le Developement de l’Evaluation Medicale; OSTEBA= Evaluación de Tecnología Sanitaria del Gobierno Vasco; GR= Health Council of the Netherlands; NCCHTA= National Coordinating Centre for Health Technology Assessment; GPAC= Guidelines & Protocols Advisory Committee; AEC= Asociación Española de Cirujanos; ICSI= Institute for Clinical Systems Improvement; IMC= índice de masa corporal.
La prevalencia de anomalías radiológicas en las RTPO varía desde el 7,5% hasta el 52% según los estudios, en función de la edad y estado físico del paciente. Las razones que explican estas amplias diferencias entre los autores son: los criterios empleados para definir anomalía en la RTPO, las diferencias de edad de los pacientes estudiados y el número de radiólogos que interpretan las radiografías de tórax. Diversos estudios demuestran también la existencia de una clara relación entre el porcentaje de anomalías en las RTPO y la edad de los pacientes (un 6,2% de anormalidades en adultos sanos, que se incrementan hasta el 72,4% en pacientes con patología pulmonar conocida). En la población infantil las anormalidades oscilan entre el 6 y el 10%, siendo en pacientes mayores de 60 años del 43-56%. Existen una serie de subgrupos en los que se ha confirmado una mayor prevalencia de presentar anomalías radiológicas (patología cardiovascular conocida, patología pulmonar, tabaquismo superior a 10 cigarrillos/día, etc.)(17.4-17.13, 17.19, 17.20).
El porcentaje de anomalías encontradas en la RTPO y no esperadas por la historia clínica del enfermo, así como el porcentaje de cambios de actitud realizados como consecuencia de las anormalidades radiológicas no esperadas, fue inferior a 6% en todos los estudios revisados. Por todo ello, sólo se debería solicitar una RTPO en pacientes con factores de riesgo respiratorio y cardiovascular presentes y que no tengan otra radiografía de tórax en los últimos doce meses (tabla 2) (17.3-17.5, 17.7-17.9, 17.11, 17.12, 17.14). Uno de los argumentos que esgrimen los defensores de la RTPO para que ésta se realice de forma rutinaria, es la posibilidad de establecer una valoración basal con la que poder comparar en el postoperatorio si aparecen complicaciones. Las tasas de complicaciones intraoperatorias e infecciones respiratorias postoperatorias no son diferentes a los valores de infección respiratoria nosocomial encontradas en otras áreas del hospital (0,2%-7,8%), por lo que, si la radiografía de tórax no es una prueba diagnóstica rutinaria cuando un paciente ingresa en el hospital, tampoco debería serlo cuando el paciente ingresa para ser sometido a una intervención quirúrgica programada (17.18, 17.19, 17.21).
| Tabla 17.3. Recomendaciones Solicitud de Pruebas de Laboratorio Preoperatorias en Cirugía Electiva Extraída de las Revisiones Sistemáticas de la Literatura | |||
|---|---|---|---|
| HEMOGRAMA | ESTUDIO COAGULACIÓN | BIOQUÍMICA SANGUÍNEA | |
| SBU 1989(3) | Cirugía potencialmente hemorrágica. Pacientes sintomáticos según enf. de base. | No recomendado | No está indicada |
| ANDEM 1992 (4) | Cirugía potencialmente hemorrágica. Cirugía menor: en < 1 año, ancianos, embarazadas e inmigrantes de países en vías de desarrollo. Signos de anemia, poliglobulia y enfermedades asociadas con anemia. | Si la anamnesis sugiere riesgo de hemorragia, < 1 año o pacientes no interrogables. Pacientes con tratamientos especiales. | No está indicada |
| OSTEBA 1994 (5) | Cirugía potencialmente hemorrágica (más de 500 mL). Pacientes <1 año, > 60 años y mujeres en edad fértil. | Si la anamnesis sugiere problemas de coagulación. Hemostasia quirúrgica difícil. Bebedor >500 mL de vino o equivalente. | BUN o creatinina y glucemia en >40 años. |
| GR 1997 (7) | Cirugía potencialmente hemorrágica. Pacientes < 1 año y de origen no caucásico. Pacientes con neoplasia, enf. renal, HTA, ACO y BNCO. | Si la anamnesis sugiere alteración hemorrágica. Pacientes con neoplasia evolucionada, alteración probada de la hemostasia, hepatopatía o ACO. | Creatinina en >60 años. Pacientes en tratamiento: Diuréticos (creatinina, K+); Digoxina (creatinina, K+); Corticoides (glucosa, K+). Diabéticos, enf. Renal, HTA grave. |
| NCCHTA 1999 (8) | No está indicado | Si la anamnesis sugiere alteración hemorrágica | No está indicada |
| SEDAR 1996 (22) | Niños, > 60 años y mujeres en edad fértil. | Bebedores de > 500 mL de vino o equivalente. | Creatinina y glucosa en > 65 años. |
| GPAC 2000 (9) | Neonatos y niños < 1 año. Pacientes con enf. hepática, renal y ACO. | Pacientes con enf. hepática, renal y ACO. | Pacientes en tratamiento diurético, diabéticos y enf. renal. |
| ACE 2001 (14) | Cirugía potencialmente hemorrágica. Mujeres edad fértil > 60 años. Enfermedades asociadas con repercusión hematológica | Si la anamnesis sugiere alteración hemorrágica. Tratamientos que afectan la hemostasia. Bebedores de > 500 mL de vino o equivalente (>60 g alcohol/día) Anestesia espinal (opcional) | Glucemia, perfil hepático y renal en >40 años. Síntomas indicativos de enf. sistémica. Pacientes en tratamiento diurético, corticoides o digitálicos |
| ICSI 2008 (12) | Pacientes con historia conocida o reciente sugerente de anemia o pérdida sanguínea. | Historia conocida de alteración de coagulación o ACO. Historia reciente de problemas de coagulación. Tratamiento ACO postoperatorio. | Solicitar K+ en pacientes en tratamiento con digitálicos y diuréticos. |
| ENZIMAS HEPÁTICAS | ANÁLISIS DE ORINA | TEST DE EMBARAZO | |
| SBU 1989(3) | |||
| ANDEM 1992 (4) | |||
| OSTEBA 1994 (5) | Cirugía para inserción de prótesis. Manipulación de vías urinarias. | ||
| GR 1997 (7) | |||
| NCCHTA 1999 (8) | Casos sugestivos de infección urinaria. | ||
| SEDAR 1996 (22) | Bebedores > 500 mL de vino o equivalente. | Mujeres que no pueden descartar definitivamente el embarazo. | |
| GPAC 2000 (9) | Enfermedad hepática. | Mujeres que no pueden descartar definitivamente el embarazo. | |
| ACE 2001 (14) | Sólo en casos indicativos de infección urinaria | ||
| ICSI 2008 (12) | |||
SBU= The Swedish Council on Technology Assessment in Health Care; ANDEM= Agence Nationale pour le Developement de l’Evaluation Medicale; OSTEBA= Evaluación de Tecnología Sanitaria del Gobierno Vasco; GR= Health Council of the Netherlands; NCCHTA= National Coordinating Centre for Health Technology Assessment; SEDAR= Sociedad Española de Anestesiología y Reanimación; GPAC= Guidelines & Protocols Advisory Committee; ACE= Asociación Española de Cirujanos; ICSI= Institute for Clinical Systems Improvement.
HTA= Hipertensión arterial; ACO= Tratamiento con anticoagulantes orales; BNCO= Bronconeumopatía crónica obstructiva; BUN= Nitrógeno ureico sanguíneo; K+= Potasio sérico
No tiene acceso al contenido completo de este capítulo.
Puede comprar únicamente este capítulo por 10,00€.

Desde los albores de la medicina se conoce la importancia de garantizar una correcta ventilación pulmonar y oxigenación para mantener la vida. La intubación traqueal, que los anestesiólogos realizan rutinariamente en la actualidad, ha sido fruto de siglos de estudios, experimentos y ensayos clínicos (21.1, 21.2). Así la primera intubación orotraqueal en humanos fue descrita por el médico persa Avicena (980-1037) (21.3).
Durante muchos años, el éter y el cloroformo se administraron con mascarilla y únicamente se intubaba la tráquea en casos de reanimación por parada cardiorrespiratoria. Desde los finales del siglo XIX (1880 William MacEwen) y hasta los comienzos del siglo XX todas las técnicas de intubación se practicaban a ciegas guiándose por palpación con los dedos, a pesar de que Manuel García, había inventado el “espejillo laríngeo” o laringoscopio de visión indirecta en 1840. En 1899 Chevalier Jackson, fabricó en Filadelfia el primer laringoscopio de visión directa y más tarde los anestesiólogos ingleses Harold Gillies, Edgar S. Rowbotham e Ivan W. Magill sistematizaron la intubación traqueal diseñando laringoscopios, tubos, conexiones y toda clase de aparatos y accesorios como las pinzas de Magill. Rowbotham realizó en 1920 la primera intubación nasotraqueal a ciegas, y Waters y Guedel en 1928, introdujeron los manguitos hinchables. En 1942 Harold Griffith y Enid Johnson en Montreal, utilizaron por primera vez el curare en una anestesia para facilitar la relajación muscular durante la cirugía, que más tarde se usaría para facilitar la intubación. En 1895 J.A. Azula de Bogotá, Colombia describe diversas complicaciones asociadas a la administración de cloroformo como el laringoespasmo y la apnea, que según el Dr. Azula, se pueden controlar anestesiando tópicamente las mucosas nasales y orales con una solución de cocaína. En 1.859 Niemann en la universidad de Goettingem, aisló y dió nombre al alcaloide de las hojas de coca, extendiéndose su uso como como anestésico local en Europa y Estados Unidos.
En las últimas décadas el interés por el tratamiento de la vía aérea en anestesia ha motivado la organización de sociedades científicas focalizadas en este campo: Society for Airway Management (1995, USA) y European Arway Management Society (2003, UE), así como comités en las Sociedades Nacionales de Anestesia dedicados a elaboración de guías y recomendaciones para el control de la vía aérea (21.4).
El interés suscitado entre los profesionales por el control eficiente de la vía aérea, viene determinado por la morbimortalidad atribuible a los incidentes registrados en la práctica clínica.
La recogida de datos que proporcione información acerca de la naturaleza y frecuencia de sucesos adversos relacionados con el control de la vía aérea, es incompleta y de calidad defiente, mientras que la tasa de demandas por mala praxis en el contexto del tratamiento de la vía aérea, ha facilitado mejoras en la práctica clínica. Aunque las denuncias en este campo supongan un porcentaje muy pequeño del total conocido contra anestesiólogos, la gravedad de los daños ocasionados con resultado de muerte o daño cerebral irreversible supone una tasa relativamente alta de tratamiento inadecuado, limitado igualmente por la carencia de información referente a la incidencia y prevalencia de complicaciones.
Considerando que los incidentes graves son los más difíciles de recoger por las causas legales comentadas, el trabajo de auditoría de Cook en el Reino Unido (NAPA4 2011), revela un total de 46 sucesos por millón de anestesias generales (IC 95% 38-54), 1 por cada 22.000 anestesias (IC 95% 1 cada 26-18.000), con una tasa de mortalidad o daño cerebral irreversible de 5,6 por millón de anestesias generales (IC 95% 2,8-8,3), 1 por cada 180.000 (IC 95% 1 cada 352-120.000). Estos porcentajes difieren muy poco en función del dispositivo utilizado en la maniobra, máscara facial, dispositivo supraglótico o tubo endotraqueal. Entre todas las muertes atribuibles, la técnica practicada para el control de la vía aérea fue considerada inadecuada en tres cuartas partes de los casos, mientras que se juzgó adecuada en 3 casos. Aunque estas cifras puedan inducir a creer baja la incidencia de muerte o daño cerebral irreversible atribuible al control de la vía aérea durante la anestesia general, el análisis estadístico de la distribución de recogida de casos sugiere que el porcentaje de incidentes recogidos no superaría el 25% de los estimados. Si bien la tasa de complicaciones por incidentes puede considerarse baja, la revisión del tratamiento de la vía aérea en los casos afectados, sugiere que hay un margen considerable de mejora de la técnica practicada (21.5).
El grupo de trabajo de Cook ha revisado igualmente las complicaciones relacionadas con el tratamiento de la vía aérea en áreas del Hospital fuera de quirófano, en Unidades de Cuidados Críticos y Reanimación, y Servicios de Emergencias (21.6). Durante el periodo de 1 año en el que se han recogido los datos, el total de sucesos aparecidos al margen de anestesia que cumplieron criterios de inclusión, ha sido de 184. Las complicaciones atribuibles al tratamiento de la vía aérea incluyen muerte, daño cerebral, vía aérea quirúrgica de emergencia, ingreso no previsto en Unidad de Críticos y estancia prolongada en estas Unidades. Del total recogido (n 184), 36 ocurrieron en Unidades de Críticos y 15 en Servicios de Emergencias. De los acaecidos en Unidades de Críticos, el 61% acabaron en muerte o daño cerebral irreversible, mientras que lo hicieron el 31% de los ocurridos en Servicios de Emergencias. A diferencia de los sucesos que tuvieron lugar durante la anestesia, las complicaciones en Unidades de Críticos y Servicios de Emergencias tienen más probabilidad de ocurrir en horario con menor presencia de anestesiólogos (tarde-noche/festivos), y con personal menos experto en el tratamiento de la vía aérea, lo cual tiende a ocasionar daños irreversibles. La falta de monitorización de la capnografía ha resultado ser la variable de mayor peso, contribuyendo al 74% de los casos de muerte o daño cerebral irreversible.
Esto supone que 1 de cada 4 complicaciones atribuibles al tratamiento de la vía aérea en el Hospital, suceden en Unidades de Críticos o Servicios de Emergencias, datos que son especialmente preocupantes porque en los casos recogidos se han evidenciado errores repetidos, como la deficiente identificación de pacientes con mayor riesgo de vía aérea difícil, plan de actuación inadecuado, falta de formación del personal y de dispositivos suficientes para el correcto tratamiento de la vía aérea, incapacidad para reconocer a tiempo la situación clínica del paciente, y fallo en las maniobras de rescate por falta de interpretación de la capnografía. También sobre 3,423 situaciones de intubación traqueal de urgencia hospitalaria y fuera del quirófano, Martín (21.7) encuentra una incidencia de intubación difícil del 10,3%, con una tasa de complicaciones del 4,2% distribuidas entre aspiración 2,8%, intubación esofágica 1,3%, rotura piezas dentales 0,2% y neumotórax 0,2%, recomendando la presencia de personal experto para atender estos casos.
Respecto a la técnica utilizada, Crosby compara la idoneidad de las diversas alternativas disponibles para el control de la vía aérea en pacientes con traumatismo cervical inestable severo. En todos los casos, el tratamiento de la vía aérea supone algún movimiento espinal incluso con maniobras de inmovilización cervical asociadas. Si bien la indicación por parte de los anestesiólogos de la técnica a utilizar en estos casos es la intubación traqueal con fibrobroncoscopio, no existe significación estadística que aconseje este dispositivo frente a otras técnicas y dispositivos de elección o rescate para el control de la vía aérea (21.8).
Descripción y funcionalidad de las estructuras que soportan las maniobras para el control de la vía aérea.
La cavidad oral se extiende desde los labios anteriormente hasta los pliegues palatoglosos posteriormente. La boca tiene cuatro lados: techo, piso y paredes laterales. El techo está formado por el paladar duro y el paladar blando. El paladar duro lo conforman el hueso palatino y el hueso maxilar. El paladar duro forma a su vez el lado interno del piso de la cavidad nasal. El paladar blando está formado por el músculo esquelético que interviene en el cierre de la cavidad nasal al deglutir y ayuda a mantener abierta la faringe al respirar. Los músculos palatoglosos (X par) y palatofaríngeo (X par) tensan el paladar blando junto con el músculo de la úvula (X par) y el tensor del velo del paladar (V par). El músculo palatogloso también ayuda a levantar la lengua mientras levanta la laringe durante la deglución. La mandíbula forma el marco estructural del piso de la boca, que completan la articulación temporomandibular y la lengua (21.9, 21.10).
La articulación temporomandibular es la única articulación móvil de la cabeza. Posee dos compartimentos sinoviales que están separados por un disco articular fibrocartilaginoso. Esta organización le permite movimientos de apertura, cierre, avance anterior, retracción y laterales. El avance anterior lo realizan los músculos pterigoideos laterales; la retracción los músculos temporales y el cierre, los músculos pterigoideos medio, maseteros y temporales. De especial importancia son los músculos maseteros, los cuales tienen un tipo especial de fibras que a ciertos estímulos pueden responder con contracciones lentas y tónicas precipitando espasmo o trismo. El trauma, el dolor, la inflamación debida a infección o a irradiación pueden desencadenar el trismo de los maseteros haciendo la manipulación de la vía aérea muy difícil y a veces imposible por el cierre de la cavidad oral (21.11).
La lengua la forman varios músculos, el geniogloso, que avanza anteriormente la lengua y ayuda a que la vía aérea quede expuesta, el músculo hipogloso que se origina en el hueso hioides y el músculo estilogloso que se origina en la apófisis estiloides del hueso temporal.
Por su tamaño, movilidad y por su unión a la mandíbula, hueso hiodes y epiglotis, la lengua juega una parte importante en mantener permeable la vía aérea. La subluxación anterior de la mandíbula mueve anteriormente la base de la lengua, facilitando la ventilación espontánea o asistida con mascarilla facial en el paciente inconsciente.
La parte posterior de la lengua esta inervada por el nervio glosofaringeo, por debajo del arco palatogloso, de fácil acceso para el bloqueo con anestésicos locales.
La forma y estado de la dentadura del paciente son factores importantes a considerar durante una laringoscopia rígida, mientras que en pacientes desdentados es más difícil la ventilación con máscara facial (21.12).
Es la estructura más fija del tracto respiratorio. Las dos cavidades nasales son dos cámaras paralelas separadas entre sí por un cartílago septal o pared medial. Consta cada una de narina y coana, además de piso y techo. Los orificios externos o narinas y los orificios posteriores o coanas. El tamaño de las narinas condiciona el del tubo naso-traqueal practicable. La distancia entre las narinas y la carina es en promedio de 32 cm en el hombre y 27 cm en la mujer (21.13).
La inervación sensorial de la mucosa nasal está dada por la rama oftálmica y maxilar del nervio trigémino. La inervación simpática de la nariz proviene del ganglio cervical superior. El aporte de sangre a la mucosa nasal es abundante y está provisto por la arteria esfenopalatina, rama de la arteria maxilar y por la rama septal de la arteria facial. Estas dos arterias se anastomosan entre sí formando la red o plexo de Kiesselbach en la pared anterior medial de la nariz.
Es una estructura muscular de forma tubular de 12 a 15 cm y se extiende desde la base del cráneo hasta el cartílago cricoides, a nivel de sexta vértebra cervical donde se continúa con el esófago. Se divide en nasofarínge, orofarínge e hipofarínge. El músculo cricofaríngeo actúa como un esfínter a la entrada del esófago, para evitar la regurgitación del contenido gástrico (21.14).
La faringe está inervada por los nervios trigémino, vago y glosofaríngeo. El nervio laríngeo superior, rama del nervio vago, transmite impulsos aferentes de la base de la lengua y la valécula. El reflejo nauseoso es desencadenado al estimular la pared posterior de la faringe precipitando la contracción de los músculos de la faringe. La vía aferente del reflejo de náusea es el nervio glosofaríngeo y la eferente es el nervio vago, forman un arco reflejo con fibras simpáticas que se dirigen al corazón y vasos sanguíneos, responsables de la respuesta hemodinámica por estimulación.
Es esencialmente una válvula protectora situada en la parte superior del tracto respiratorio, tiene propiedades de esfínter, y contiene al órgano de la fonación. En el adulto la laringe mide cerca de 5 a 7 cm (es más corta en las mujeres), descansa opuesta a la cuarta, quinta y sexta vértebras cervicales, y se continúa inferiormente con la parte superior de la tráquea y en su parte superior con la faringe.
No tiene acceso al contenido completo de este capítulo.
Puede comprar únicamente este capítulo por 20,00€.

Los primeros intentos(23.1) reportados de practicar una anestesia intravenosa los realizó en Inglaterra el científico arquitecto y astrónomo Christopher Wren (1632-1723) en 1657 utilizando una solución de opio. El cirujano ruso Pirogoff intentó en los años siguientes perfundir éter por vía venosa. El fracaso fue absoluto por el efecto hemolítico del éter no diluido. En ese momento las limitantes técnicas de administración y el desconocimiento de la farmacología generaron grandes catástrofes.
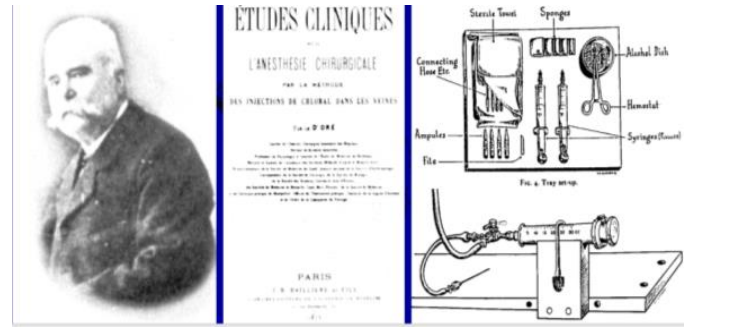
En la Figura 23.1 Pierre-Cyprien Oré (1823-1889) realiza, en Francia en 1873, la primera anestesia exitosa en humanos con perfusión i.v. de Hidrato de Cloral.
Entre 1864, cuando Adolf von Baeyer descubre el ácido barbitúrico, y 1932 cuando aparecen el tiopental, se incuba el germen conceptual de la técnica i.v. Los aportes de Lundy en la caracterización y diferenciación de los componentes de la anestesia (hipnosis, amnesia, analgesia, estabilidad vegetativa y la relajación muscular) eran objetivos independientes a manejar e incompatibles con la monoanestesia barbitúrica. Es la primera propuesta de anestesia balanceada. Lundy publica uno de los primeros textos sobre anestesia i.v. (fig 23.2).
Con anterioridad, en América un misionero jesuita del Casanare, el Padre José Gumilla, realiza en 1745 una primera descripción Yanamami de “el arma que mata bajito” o ourari (curare). A partir de ahí, en 1856, Claude Bernard comunica las acciones fisiológicas esenciales del chondrodendum tomentosum, sobre la unión mioneural. Para 1942, Griffith y Johnstone usan curare por primera vez en anestesia clínica en Canadá. El desarrollo posterior de los relajantes musculares ha sido vertiginoso, pasando por los hidrolizables por pH y temperatura, hasta los actuales antagonistas como sugamadex.
A mediados del siglo XX comienza el desarrollo de diversas variantes de la técnica i.v.
En 1945, la llamada Anestesia Balanceada en Inglaterra en base a barbitúricos, opioides, N2O y bloqueantes neuromusculares. En Francia Laborit y Huguenard en 1950 practican la técnica de Hibernación Artificial o "Cocktail Lítico” (petidina, prometazina, clorpromazina) y otros casi 20 medicamentos. Las técnicas de hibernación se abandonaron rápido, pero dieron un gran impulso a la realización de anestesias i.v. y posteriores neurolepto-analgesias.
En 1959 aparece la Neuroleptoanalgesia (NLA Tipo I), por de Castro y Mundeleer en Bélgica, en base a haloperidol y fenoperidina. Esta técnica mantenía la ventilación espontanea con un paciente “mineralizado“(rígido) y con ”anestesia sin dormir“.
En Alemania en 1963 von Henschel inaugura la Neuroleptoanestesia (NLA Tipo II), priorizando el componente analgésico con meperidina. Con la aparición de fentanilo, el factor analgésico se convierte en el centro del esfuerzo anestésico. El agregado de N2O y un curare hace mutar la técnica de Neuroleptoanalgesia a Neuroleptoanestesia.
Para evitar el riesgo de despertar por el bajo efecto hipnótico del N2O se agrega en 1967 el recién aparecido Valium® (diazepam).
Es interesante la aparición en 1965 de un derivado eugenólico: Epontol® (propanidida), introducido por Zindler. Lo interesante de este medicamento fue la posibilidad de metabolización por esterasas plasmáticas, convirtiéndolo en el primer hipnótico de efecto corto. Lamentablemente los problemas hemodinámicos y frecuentes reacciones anafilácticas lo llevaron a retirar del mercado en 1990. En años posteriores el opioide remifentanilo reasumiría la vía metabólica de esterasas inespecíficas del plasma.
En 1971 se introduce por Campbell y Clarke el Althesin® que lamentablemente no cumplió las expectativas aunque, a la inversa, en 1973 con Hypnomidate® (etomidato) (Doenicke) aparece un hipnótico cercano al ideal. En combinación con fentanilo y un bloqueante neuromuscular aparece al fin la Total Intravenous Anaesthesia (TIVA) y se cumple con los predicamentos de la anestesia balanceada: un hipnótico específico, un analgésico y un relajante de la musculatura esquelética. Schüttler y Stoeckel inician entonces los estudios farmacocinéticos para la administración óptima de etomidato-fentanil. Ellos se basan en los modelos de estudios de 1968 publicados en el European Journal of Pharmacology por E. Krüger-Thiemer: “Continuous Intravenous Infusion and Multicompartment Accumulation“. Nuevos problemas aparecieron con la descripción de las muertes silentes por fentanilo en un editorial de Anesthesiology de H.F.Cascorbi, y J.S.Gravenstein en abril de 1974.

Ello es explicado farmacológicamente por Stoeckel et al. en 1979 en British Journal como causado por los efectos recirculatorios del fármaco. Se comienza a crear la necesidad de perfeccionar el conocimiento de la cinética de los opioides y de contar con uno que sea más evanescente pero potente. Esas descripciones balancearon la anestesia nuevamente hacia los hipnóticos (fig 23.3).
Como la historia se escribe frecuentemente entre paradojas, esta se presentó con la primera descripción de una anestesia i.v. continua que fue realizada por un fármaco clásico de uso inhalado: el éter. En la figura 23.4 se observa la descripción de la cinética y el extracto de la publicación en 1976 en Holanda, donde se utiliza éter en perfusión continua.

En 1983 aparece la descripción de que el etomidato producía inhibición de la corteza suprarrenal en pacientes con perfusiones prolongadas. Esto limitó de inmediato su uso y a pesar del excelente perfil cinético y la alta estabilidad hemodinámica, aún no superada, se le dejó relegado solo a la inducción anestésica de pacientes inestables.
Cuando en 1977 Kay y Rolly introducen Diprivan® (propofol) se pudo, al fin, practicar la TIVA en plenitud. El Propofol llenó las expectativas farmacocinéticas y farmacodinámicas de sus seguidores y en combinación con el nuevo opioide de efecto muy rápido Rapifen® (alfentanilo), en 1980 introducido por Kay y Schüttler, se contó con un fármaco analgésico mejor perfilado que fentanilo.
El “Closed-Loop-TIVA” o circuito servocontrolado guiado por electroencefalografía, desarrollado a finales de los años 80 por Schüttler y Schwilden (23.2) en la universidad de Bonn, permitió la mirada de la modelación cinético-dinámica conjugada y plasmada en el “Target-Controlled-Infusion-Anaesthesia TCI” que ellos llamaron CATIA. Esa historia comenzó a fines de los 70 con las descripciones de la cinética moderna en los años 60 y que ellos concluyen en el concepto BET (Bolo-Eliminación-Transferencia), la médula del actual TCI (fig 5).

No tiene acceso al contenido completo de este capítulo.
Puede comprar únicamente este capítulo por 15,00€.